4月18日醫療物資出口報關更新標準:
非醫用口罩出口要求:
1、生產企業名稱,必須在產品或包裝或合格證上有顯示(英文需要拿經營者備案登記證)
2、貨物里面的每個小包/盒都要有合格證(必須蓋章),產品或包裝或合格證上必須要有:
執行標準,生產批次,廠商名稱,廠商地址,生產日期,有效期(缺一不可)
3、非醫用提供聲明
4、普通口罩的貨物一是外包裝不能有中英文醫用字樣;二是執行的產品標準為非醫用標準;三是產品不能帶有FDA或CE en14683標志。帶有上面字樣,標準,標志的其中一種均為醫用口罩
5、產品檢測報告
醫用防疫物資出口要求:
1、生產企業營業執照
2、醫療器械注冊證
3、醫療物資聲明(表格不能留空,表頭不要有模板兩個字,蓋生產銷售單位公章)
4、醫療器械經生產許可證
5、廠家的檢測合格報告
6、生產廠家及注冊證商品名稱,型號要對應報關單信息,生產公司需要在海關名冊內(注冊號要在藥監局網上能查到此生產公司的信息才有效)
7、貨物里面的每個小包/盒都要有合格證(必須蓋章),產品或包裝或合格證上必須要有:
執行標準,生產批次,廠商名稱,廠商地址,生產日期,有效期,醫療器械注冊證號,醫療器械許可證號(缺一不可)
附口罩執行標準(僅供參考):
歐洲執行標準分類:
EN-149 民用
EN-143 民用
EN-14683 醫用
國內執行標準:
YY/T 0969-2013 一次性醫用
YY 0469-2011 醫用
GB 19083-2010 醫用
GB 2626-2006 民用
GB/T32610 民用
有FDA標志(ASTM F2100:19) 醫用
包裝出現醫用(MEDICAIL)字眼 醫用
近期很多客戶咨詢出口口罩、手套、防護面罩等防疫物資事宜,現整理出以下幾個常見問題和解答,希望對各位客戶有所幫助。特別提示:疫情防護用品扣關、政府征用、截留不做賠償。
所有出口醫用醫療防疫物質(包括口罩,防護服,護目鏡,體溫槍,呼吸機等等)將會嚴查,醫療物質出口中一旦出現質量問題,將會嚴格調查,依法懲處。
醫用物資需提供資料參考
1.醫療器械許可證,生產許可證
2.廠家營業執照(包括有2類醫療器械資質)
3.產品合格證;填寫出口醫療聲明模板
4.發票必需有品牌,型號 數量
5.各國認證例如(歐洲)CE (美國)FDA
口罩包裝要求:口罩必須有小紙盒包裝,每個小盒包裝內必須有一張產品合格證,不能與其它貨件混發。
無論醫用和非醫用的防疫物質如查驗產品不合格,無法提供文件等,我司一概不負責,請知悉。
聯邦渠道21KG以上,日本、美加墨可以不限量出貨,收件人清關付稅。
5KG內口罩,歐美小包特快服務,大陸DHL,時效2-4天,收件人清關付稅。
歐洲部分國家已經發生口罩等防疫物資被政府征用情況,經我司出運的防疫物資,無論到任何國家,任何渠道萬一發生被政府,海關征用的,我司無法退運費以及賠償貨值,這是政府行為,請出貨前提前告知客戶,以免引起爭議。
一、口罩等防疫物資可以出口嗎?
根據商務部消息,我國目前暫未對出口口罩設置任何貿易管理措施!也就是說,只要你按正常流程操作,有資質,海關是不會扣貨。但是根據目前的經驗,建議私人最好少量(10kg以下)出口,大量出口建議客戶咨詢當地海關相關政策,不然容易被扣關或退回,造成不必要的損失。
二、出口防疫物資需要哪些資質?
普通口罩等非醫療器械管理的疫情物資,沒有監管條件,有進出口權的企業,就可以直接出口。涉證的口罩等疫情物資,需要產品三證:A.營業執照(經營范圍包含有醫療器械相關)、B.產品備案證或者注冊證、C. 廠家檢測報告,然后有進出口經營權的企業,再行出口。
另外,如果是企業想贈送或者代替海外關聯公司采購,需要提供情況說明。
三、出口到不同國家,需要符合目的國的標準嗎?
一定要符合其他國家的標準,不然你的物資是進不去的。
出口日本要在PMD Act的要求下,TOROKU注冊系統要求國外的制造商必須向PMDA注冊制造商信息。
出口韓國需要標注原產地,并且需要有KF認證。
出口美國的口罩,必須有FDA認證。
出口歐洲的口罩必須有CE認證。
四、要出口涉證的口罩,但是沒有出口資質,怎么辦?
如果你的口罩是具備三證的工廠產出的,可以通過外貿代理進行出口銷售,如果沒有三證,那就無法出口了。
五、普通口罩和醫用口罩出口分別需要什么資質?
普通口罩和醫用口罩是指用途。而藥監局管理是按照產品和標準來管理的。二類和三類醫療器械的口罩,需要備案證或注冊證才能出口。涉證口罩所需的證件,見第二個問題。
六、貿易公司沒有醫療器械的資質可以出口口罩嗎?廠家可以提供三證,退稅有問題嗎?
可以的,廠家提供三證是完全可以出口的。當然外貿公司的營業范圍最好包括勞防用品等內容,這樣,出口退稅會更有保障。
七、個人快遞口罩到美國可以嗎?
個人行郵目前也是不禁止出口的。一般快遞美國,可以考慮FedEx、UPS、DHL、郵政等快遞公司。不過有客戶反映,海關會要求寄件人提供美國的FDA認證,所以各位客戶要寄的時候先電話咨詢目的國各個快遞公司需要什么清關資料。
八、熔噴布出口需要醫療器械證嗎?
熔噴布并不屬于醫療器械,因此不需要醫療器械證明。具體可前往國家食品藥品監督管理局官網查詢。官方網址:http://samr.cfda.gov.cn/
九、各種防疫物資商品編碼參考
口罩 6307900000
橡膠手套 4015190000
防護服 6210103000
護目鏡 9004909000
棉簽、棉棒、棉球 5601210000
體溫計 9025199090
十、部分國家口罩進口標準參考
伊朗
必要資料(資質):提單、箱單、發票。
口罩要求:
進口伊朗還是比較復雜的,需要在伊朗申請COI認證,中文為符合性核查,是伊朗進口強制發件要求的相關檢查。目前伊朗N95口罩和普通三層口罩、呼吸器、手術服、核酸檢測試劑盒、個人防護用品、防護面罩和防護服等物資告急。目前我司EMS渠道限重20KG、伊朗專線限重2KG可以承運口罩等防疫物資。
韓國
必要資料(資質):提單、箱單、發票。
韓國進口營業執照,韓國收貨人需要到韓國藥監局提前備案進口資質,官網www.kpta.or.kr。企業自用又是受贈的情況,可以自行進口,不需要有相關資質。
口罩要求:
口罩需要有詳細的原產地標識,如果是中國制造務必有標簽:Made In China、生產廠家信息、保質期,還要準備成分含量說明,制造工藝流程,不止如此,等到貨物到韓國后還需要將檢測化驗樣品,化驗合格后方可進入韓國市場銷售流通。
韓國醫用防護
(標準依據MFDSNotice NO.2015-69):
1.過濾效率80% KF80防沙塵口罩
2.過濾效率94% KF94防疫口罩
3.過濾效率99% KF99衛生保健口罩
日本
必要資料(資質):提單、箱單、發票。
出口日本的PMDA注冊醫療器械公司希望把產品投放到日本市場,必須要滿足日本PMD Act的要求,TOROKU注冊系統要求國外的制造商必須向PMDA注冊制造商信息。
口罩要求:
包裝上印有ウィルスカット99%的字?樣?都是超過國內過濾效率95%(N95口罩)標準的醫用口罩。
PFE:0.1um微粒子顆粒過濾效率
BFE:細菌過濾率
VFE:病毒過濾率
ウィルスカット:病毒攔截
醫用防護口罩:符合中國GB19083-2010強制性標準,過濾效率≥95%(使用非油性顆粒物測試)。
N95口罩:美國NIOSH認證,非油性顆粒物過濾效率≥95%。
KN95口罩:符合中國GB2626強制性標準,非油性顆粒物過濾效率≥95%。
澳大利亞
必要資料(資質):提單,箱單,發票
口罩要求:
AS/NZS 1716:2012是澳大利亞和新西蘭的呼吸保護裝置標準,相關產品制造流程和測試必須符合本規范。該標準規定了防顆粒口罩制造過程中必須使用的程序和材料,以及確定的測試和性能結果,以確保其使用安全。
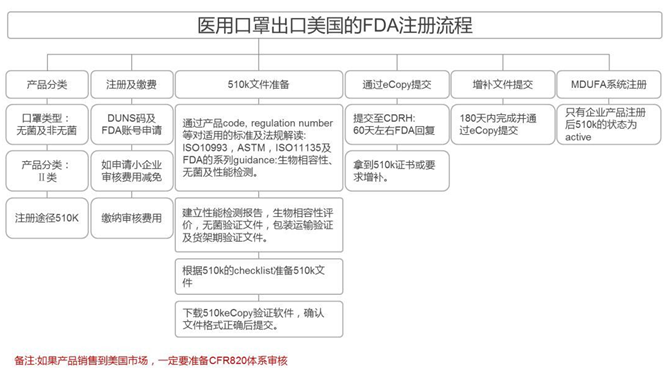
美國
必要資料(資質):提單、箱單、發票。
口罩要求:
美國進口的口罩,若需要銷售,必須要拿到FDA認證才可以在美國本土市場進行銷售活動。對于自用和贈送的口罩,大家在出口的時候最好先問一下美國接收方,是否也需要FDA認證,或者采購原本就通過FDA認證的口罩進行出口。
根據HHS(美國衛生及公共服務部)法規,NIOSH(美國國家職業安全衛生研究所)將其認證的防顆粒物口罩分為9類。具體的認證則由NIOSH下屬的NPPTL實驗室操作。
在美國,按過濾網材質的最低過濾效率,可將口罩分為三種等級——N 、R 、P:
?N類口罩只能過濾非油性顆粒物,比如:粉塵、酸霧、漆霧、微生物等。空氣污染中的懸浮微粒,也多是非油性的。
?R類口罩只適合過濾油性顆粒物及非油性顆粒物,但用于油性顆粒物時限制使用時間不得超過8小時。
?P類口罩則既可過濾非油性顆粒物,又可過濾油性顆粒物。油性顆粒物比如:油煙、油霧等。
根據過濾效率的不同,又有90、95、100的差別,分別指在標準規定的測試條件下最低過濾效率為90%、95%、99.97%。N95不是特定的產品名稱。只要符合N95標準,并且通過NIOSH審查的產品就可以稱為“N95型口罩”。
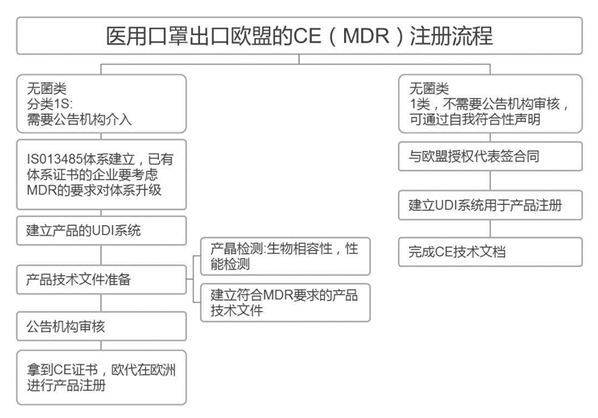
歐盟
必要資料(資質):提單,箱單,發票。
口罩要求:
在歐盟,口罩屬于PPE個人防護用品。2019年起,歐盟新法規PPE Regulation(EU)2016/425強制執行,所有出口歐盟的口罩必須在新法規的要求下獲得CE認證證書。CE認證證書的有效期是5年左右,一般費用是10000~15000元人民幣。

歐盟對于口罩歐洲統一,CE認證的標準包括BSEN140、BSEN14387、BSEN143、BSEN149、BSEN136,其中BSEN149使用多,為可防護微粒的過濾式半口罩,根據測試的粒子穿透率分為P1(FFP1),P2(FFP2),P3(FFP3)三個等級,FFP1低過濾效果≥80%,FFP2低過濾效果≥94%,FFP3低過濾效果≥97%。
FFP2口罩與上文提到的醫用防護口罩、KN95口罩、N95口罩過濾效率十分接近。醫療口罩必須遵循BSEN14683標準,可以分為三個等級:低標準Type、然后是Type和TypeR。上一個版本是BSEN146832014,已被新版BSEN146832019所取代。EN 14683:2019年版主要的變化之一是壓力差,Type、Type、TypeR壓力差分別由2014年版的29.4、29.4、49.0Pa/cm,上升至40、40、60Pa/cm。
CE認證是歐盟實行的強制性產品安全認證制度,目的是為了保障歐盟國家人民的生命財產安全。
總結:口罩如何出口
銷售、贈送或代采購、個人行郵方式
一、用于銷售
需要經營范圍內有醫療器械經營許可證的,進出口權的,才能出口。
二、用于贈送或代為采購
作為贈送的,或者代關聯公司(兄弟公司,母子公司)采購的,要提供采購的廠家或公司的國內生產廠家的相關資質證明文件,與我們進口時要國外提供三證(營業執照,產品醫療器械備案證明,廠家檢查報告)一個道理。
三、個人行郵方式:
1.由于每個國家關于進口口罩的要求不同,建議大家出口前務必咨詢當地的代理公司或者
接收方,避免物資被扣或者被退回的問題。
2.自用口罩的出口以及快遞,數量一定要在合理范圍,建議單票10KG內,如果數量巨大也有可能被國外海關扣押。
3.目前航空、海運運力還沒有完全恢復,運輸時間都相對較長,建議在發貨后留意單號更新,同時耐心等待,只要沒有違規問題,一般不會被扣押或者退回。
4、口罩出口,詳細說來需要提供如下資料信息:
1-營業執照
2-企業生產許可證
3-產品檢驗報告
4-醫療器械注冊證
5-產品說明書、標簽。
6-產品批次/號
7-產品質量安全書
8-產品樣品圖片及外包裝圖片
建議中國賣家及時關注國內外防疫物資出口資質認證和監管要求,避免造成產品被扣押和退回的風險。屬于醫療器械類的口罩,不同國家的資質和要求都不相同,這點賣家們一定要注意。國內外銷售都需要先獲得《第二類醫療器械經營備案憑證》,若想在跨境平臺銷售,除了類目審核,還需要產品認證,歐美必須通過當地國家認證許可,如歐盟CE認證,美國NIOSH認證。歐盟CE認證還需要注意包裝、質量符合要求,要有歐洲代理信息。并最好保留好認證證書,采購發票或原材料發票。
勝利通環球,助力全球抗戰疫情,我司聯邦、TNT、DHL、UPS、EMS、歐美雙清包稅專線等渠道均可正常出貨,歡迎各位客戶咨詢相關防疫物資出口問題。
勝利通
2020-3-13


